¿Qué debería considerar antes de participar en un ensayo clínico?
Participar en un ensayo clínico significa una oportunidad para los pacientes, ya que de esta manera pueden acceder voluntariamente a tratamientos innovadores de los que de otra forma no sería posible. Esto podría suponerles un beneficio y una mejora de su estado de salud. Además, es una ocasión para ayudar a otros pacientes y a la sociedad, al contribuir al desarrollo de nuevos tratamientos que mejoren la salud o ayuden a prevenir enfermedades, permitiendo de esta forma el avance de la ciencia.
Es importante recordar que participar en un ensayo clínico conlleva no sólo posibles beneficios, sino también hay que asumir la posibilidad de algún riesgo: no existe garantía de que el nuevo tratamiento sea mejor que el tratamiento de referencia (el ya existente para la enfermedad objeto del estudio), y, además, pueden aparecer algunos efectos adversos. Un ensayo clínico se lleva a cabo para encontrar respuestas: para ver si un fármaco nuevo es realmente beneficioso o si es mejor o más seguro que uno ya existente, de manera que hay preguntas que no se podrán contestar hasta que el ensayo no haya concluido.
Ningún nuevo medicamento es comercializado si antes no se prueba en los ensayos clínicos.
¿Qué implica participar en un ensayo clínico?
Todas las personas que participan en un ensayo clínico son voluntarias, con independencia de si son sujetos sanos o padecen la enfermedad o afectación que el ensayo pretende tratar.
La participación en un ensayo clínico es voluntaria, de forma que en cualquier momento y por cualquier motivo, el participante puede abandonar el estudio sin tener que manifestar justificación alguna para ello y sin que esto afecte a la relación con su médico o al tratamiento que va a recibir.
Todos los participantes en un ensayo clínico tienen unos derechos protegidos por ley, los cuales están recogidos en el consentimiento informado.
Normalmente, la participación en un ensayo clínico conlleva la realización de pruebas adicionales, como pueden ser los análisis de sangre y exploraciones, junto con un mayor contacto y seguimiento por parte de los profesionales sanitarios y del equipo de investigadores. La información médica y personal de los sujetos participantes en un ensayo se mantendrá siempre confidencial y segura de acuerdo con la legislación vigente.
Es importante recordar que participar en un ensayo clínico conlleva no sólo posibles beneficios , sino también riesgos:
- El nuevo tratamiento puede causar efectos adversos o puede implicar algunas incomodidades, por ejemplo, en la gestión de las citas médicas y seguimiento de control.
- Es posible que como voluntario no forme parte del grupo de tratamiento del medicamento experimental, sino que forme parte del grupo de control, pudiendo recibir un tratamiento estándar o un placebo.
- Es posible que el nuevo tratamiento no funcione de la forma esperada o que no sea mejor que el tratamiento estándar ya existente
¿Es seguro participar en un ensayo clínico?
Los ensayos clínicos se rigen por una estricta legislación. Durante cada ensayo, las autoridades gubernamentales, así como el propio Board de Seguridad Global (GSB), se encargan de controlar cada uno de los procedimientos.
Participar en un ensayo clínico puede conllevar ciertos inconvenientes, como son, la aparición de posibles efectos secundarios, la falta de eficacia del tratamiento experimental o la asignación al grupo control (por lo que puede recibir placebo, producto sin acción farmacológica, esto dependerá del diseño del estudio). Sin embargo, son muchos más los beneficios que se pueden esperar, entre otros, figuran los siguientes:
- La posibilidad de recibir una atención médica más personalizada acudiendo a revisiones de forma más frecuente y haciendo de esta forma un seguimiento más exhaustivo de la enfermedad.
- Acceso a nuevas terapias o medicamentos para aquellas personas para las que el tratamiento estándar ya no sea una opción, tras probarse que dichas opciones han resultado ser ineficaces.
- Participar en un ensayo clínico es la forma más rápida y segura de acceder a un nuevo tratamiento.
- La satisfacción personal por el apoyo dado a la comunidad científica.
Existen una serie de elementos fundamentales para garantizar protección al paciente que participa en un ensayo clínico:
- Protocolo: Es el documento donde se reflejan los datos que se tienen del nuevo medicamento y la justificación para el desarrollo del ensayo clínico, adhiriéndose a las normas de Buenas Prácticas Clínicas. En él se describen los objetivos, diseño, metodología, consideraciones estadísticas, así como aspectos relacionados con la organización del estudio.
- Investigador Principal. Responsable y encargado de dirigir la realización del estudio.
- Comité de Ética. Organismo encargado de otorgar la aprobación del estudio, vela por la protección y bienestar de los participantes.
- Consentimiento informado. Documento a través del cual se informa a los sujetos participantes del estudio de la información detallada sobre el estudio, incluyendo aspectos éticos y legales.
En los ensayos clínicos existe una póliza de seguro de responsabilizad civil para cubrir eventuales reclamaciones derivadas de la participación en el ensayo.
¿Cuáles son los pasos para participar en un ensayo clínico?
En todo momento, será el propio médico del paciente el que le indicará el proceso a seguir si desea participar en un ensayo clínico.
Participar en un ensayo clínico conlleva:
- Cumplir unos requerimientos médicos (criterios de inclusión) que vienen explicados en el consentimiento informado del estudio (edad, historial médico, etc.), estos requisitos contribuyen a que el resultado sea fiable. Será el personal médico el que valorará si el paciente puede ser un participante candidato en un ensayo clínico.
Es importante que el candidato comente con el médico del estudio los beneficios del tratamiento en investigación y los posibles efectos secundarios que se puedan derivar del mismo, para asegurar que se entiende lo que implica participar en un ensayo clínico.
- Firmar un consentimiento informado: acuerdo voluntario que se firma para participar en un ensayo clínico una vez que el paciente ha comprendido la información que se le ha dado acerca de los objetivos del estudio, los beneficios, los posibles efectos secundarios, los riesgos, así como sus derechos.
- Someterse a varias pruebas como por ejemplo análisis de sangre o exploraciones complementarias (radiografías, ecografías biopsias, etc.) antes o durante el transcurso del ensayo.
- Visitas frecuentes al centro médico, normalmente se realiza un seguimiento por parte de los profesionales sanitarios y equipos investigadores que recogerán la información necesaria para poder evaluar en detalle el nuevo tratamiento.
Participación y diversidad en ensayos clínicos
Los ensayos clínicos, y quienes participan como voluntarios, son fundamentales para encontrar maneras de combatir las enfermedades.
La experiencia ha demostrado que puede haber diferencias en la manera en la que distintas personas responden a los tratamientos, por ello las personas inscritas en un ensayo deben ser representativas de los tipos de pacientes que probablemente lo usarán.
a) Ensayos clínicos en población sana
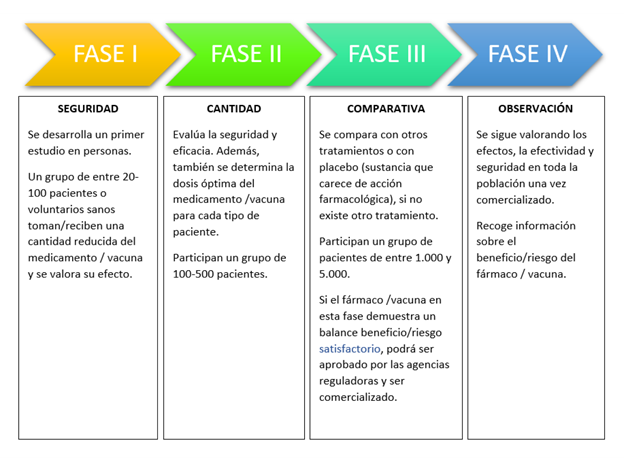
La primera vez que se testa un nuevo medicamento en humanos se habla de ensayos clínicos de fase I y generalmente se realiza en voluntarios sanos, salvo ciertas excepciones, como son los estudios sobre nuevos tratamientos para el cáncer, en los que se testa directamente en voluntarios con esta enfermedad.
Los objetivos principales de los ensayos de fase I son:
- Evaluar la tolerabilidad y seguridad del fármaco. Detectar los posibles efectos secundarios.
- Establecer la dosis más adecuada: Para ello, se prueban diferentes dosis, la dosis se aumenta poco a poco con el objetivo de encontrar la mejor, es decir, aquella que sea eficaz y que se tolere bien, evitando la aparición de reacciones adversas.
- Evaluar la mejor vía de administración, si es la oral, una inyección o una infusión intravenosa.
- Ver como el fármaco actúa en el cuerpo.
La participación de individuos sanos en las fases iniciales de los ensayos clínicos es crucial para el desarrollo de nuevos medicamentos, ya que permite que se continúe con su investigación y puedan llegar a tratar a pacientes que lo necesitan.
Los voluntarios sanos tienen que dar su consentimiento, una vez que han recibido toda la información sobre el estudio y se han aclarado sus dudas y preguntas por parte de los investigadores.
No obstante, muchos de los ensayos clínicos de vacunas se realizan en población sana.
b) Ensayos clínicos en poblaciones especiales: pacientes pediátricos, embarazadas
Población pediátrica: Para poder participar en un estudio, la persona interesada debe cumplir los criterios de inclusión. Estos criterios se utilizan para identificar a los participantes más adecuados. Por tanto, en función del tipo de ensayo y la fase, se seleccionarán para su participación unos pacientes y se excluirán otros.
Entre los criterios de inclusión suele encontrarse la edad. En principio, se pide que los sujetos sean mayores de edad (>18 años). Sin embargo, los ensayos clínicos realizados con niños también son necesarios para asegurar que la población pediátrica tiene también acceso a los nuevos avances terapéuticos, y que se les trata con la dosis y la formulación correctas, y que se ha definido el perfil de seguridad para ellos. Los resultados obtenidos en investigación clínica con adultos no son, en muchas ocasiones, extrapolables a la población infantil. Además, hay enfermedades importantes de la infancia que son prácticamente incompatibles con la supervivencia en la edad adulta.
En la población pediátrica, el consentimiento informado deberá siempre obtenerse de los padres o representantes legales. No obstante, cuando los niños estén en condiciones de comprender la información (se sitúa a partir de los 12 años ), se les proporciona una hoja de información adaptada a su grado de comprensión y por debajo de esta edad en ocasiones se debe obtener su asentimiento previamente a su inclusión en el estudio.
Embarazadas: como premisa general suelen excluirse de los ensayos clínicos a las mujeres embarazadas como medida de precaución, al desconocer los posibles efectos que podría tener el fármaco de estudio sobre el feto.
Sin embargo, las mujeres embarazadas también enferman y es importante prevenir en ellas determinadas enfermedades, por ello necesitan ser tratadas con fármacos eficaces o administrarles determinadas vacunas. Habitualmente, la información de la que se dispone de un medicamento nuevo está basada en datos no clínicos (estudios en animales). Esta falta de datos en humanos, hace que los médicos no se atrevan a dar un nuevo medicamento a una embarazada, o incluso en ocasiones, que la dejan sin tratamiento ante la duda sobre el efecto que pueda tener el fármaco en el feto. No tratar a una embarazada que lo necesite o protegerla frente a determinadas enfermedades puede suponer un riesgo para ella y para el feto.
La falta de opciones terapéuticas accesibles para las embarazadas constituye un problema de salud pública.
Hay casos en los que un ensayo ofrece un beneficio directo para la salud de la mujer y/o del feto que no podrían obtener fuera de la investigación clínica.
Al igual que para el resto de los ensayos clínicos, es necesario obtener el consentimiento de la mujer embarazada interesada en participar en el ensayo. De esta forma, cuando el propósito principal del ensayo sea obtener un beneficio directo en la mujer, el consentimiento lo deberá otorgar la propia mujer. En cambio, cuando el propósito sea obtener un beneficio directo para el feto, el consentimiento deberá ser otorgado por parte de la futura madre y del padre.