Diagnóstico del Mieloma Múltiple: pruebas y criterios
El diagnóstico del mieloma múltiple es un proceso clave para detectar esta enfermedad hematológica, que se origina en las células plasmáticas de la médula ósea. Para confirmar este diagnóstico, se deben cumplir ciertos criterios médicos específicos.
¿Qué se necesita para confirmar el diagnóstico del mieloma múltiple?
Para establecer el diagnóstico del mieloma múltiple en un paciente, es necesario que:
- En la médula ósea, al menos el 10% de todas las células sean células plasmáticas malignas,
O - Se detecte, con una biopsia, un plasmocitoma (un tumor aislado, en el hueso o fuera de la médula que está formado por células plasmáticas malignas).
Y, además, debe darse una o las dos situaciones que se detallan a continuación [1,2]:
- Daño en algún órgano que pueda atribuirse al mieloma múltiple:
- Niveles elevados de calcio (hipercalcemia) en suero sanguíneo.
- Insuficiencia renal (por niveles alterados de creatinina).
- Anemia (por valores bajos de hemoglobina).
- Lesiones óseas visibles en pruebas de imagen (TAC, PET-TAC o radiografías)
- Uno o más de estos hallazgos:
- Médula ósea en la que más del 60% de sus células sean células plasmáticas malignas.
- Ratio de cadenas ligeras y >100mg en suero.
En el análisis de las cadenas ligeras (una de las partes que forman los anticuerpos), tiene que detectarse al menos 100 veces más de estas cadenas ligeras alteradas frente a no alteradas libres en el suero sanguíneo. Además, tiene que haber al menos 100mg de estas cadenas ligeras libres alteradas por litro de suero sanguíneo. - Más de una lesión focal en una prueba de imagen (resonancia magnética [RM]).
¿Cómo se realiza el diagnóstico del mieloma múltiple?
El especialista analiza diversos factores para confirmar el diagnóstico del mieloma múltiple. Las principales herramientas, mostradas en la figura 1, son [1,3,4]:
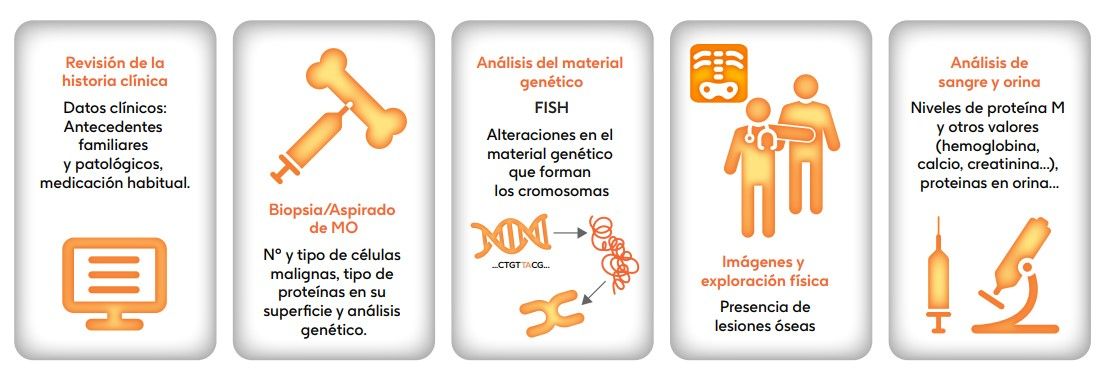
Figura 1. Procedimientos, pruebas y mediciones para el diagnóstico del mieloma múltiple
1. Revisión médica completa
- Historia clínica: información sobre síntomas, enfermedades previas o familiares con diagnóstico de mieloma múltiple.
- Exploración física general.
2. Pruebas de laboratorio
- Pruebas para evaluar las células de la sangre, incluyendo un hemograma completo.
- Pruebas para evaluar la función renal, incluida la creatinina en suero.
- Pruebas para evaluar el estado de las proteínas y otras sustancias en la sangre. incluyendo los niveles de calcio y LDH.
- Pruebas para evaluar la proteína M.
3. Biopsia y/o aspirado de la médula ósea
Se realiza un aspirado y/o biopsia para evaluar:
- El porcentaje de células plasmáticas malignas.
- Alteraciones genéticas mediante técnicas como FISH (prueba de hibridación fluorescente).
- Proteínas de superficie en las células plasmáticas, como CD38 o BCMA [7], a través de la inmunofenotipicación (estudio que analiza las proteínas mencionadas) [5,6].
4. Pruebas de imagen
El diagnóstico del mieloma múltiple puede complementarse con estudios de imagen como:
- Tomografía por emisión de positrones (PET-TAC).
- Resonancia magnética (RM).
- Serie ósea (radiografías)
- Tomografía axial computarizada (TAC).
Estas pruebas ayudan a detectar las lesiones óseas características de la enfermedad.
Pruebas adicionales en el diagnóstico del mieloma múltiple
En algunos casos se pueden realizar estudios complementarios como:
- Pruebas cardiovasculares, para evaluar el estado del corazón antes de determinados tratamientos [8].
- Radiografía de tórax, para descartar derrames pleurales [9].
- Serologías víricas, útiles para prevenir la reactivación de infecciones latentes [10].
¿Qué ocurre tras el diagnóstico del mieloma múltiple?
Una vez establecido el diagnóstico del mieloma múltiple, se evalúa el pronóstico del paciente. Para ello, se tiene en cuenta:
- El tipo y número de alteraciones genéticas en las células malignas.
- Los niveles de ciertas proteínas en sangre (albúmina, LDH y β2-microglobulina) [2].
Esto permite clasificar la enfermedad en tres estadios: I, II o III, y elegir el tratamiento más adecuado.
Lo fundamental en pocas palabras
El diagnóstico del mieloma múltiple es un proceso complejo que requiere de pruebas médicas avanzadas y el trabajo conjunto de diferentes especialidades.
La detección temprana de la enfermedad permite iniciar el tratamiento lo antes posible y así mejorar la calidad de vida del paciente.
- Grupo de Estudio de Gammapatías Monoclonales de Castilla y León. Hematoguía MIELOMA. [Internet] Disponible en https://www.sclhh.org/docs/pdf/consenso/guia%20mieloma%202024_version%20digital.pdf [Último acceso] 22 abril 2025.
- Rajkumar SV. Multiple myeloma: 2024 update on diagnosis, risk-stratification, and management. Am J Hematol. 2024;99(9):1802-24.
- National Comprehensive Cancer Network (NCCN). NCCN Guidelines for Patients: Multiple Myeloma, 2025 [Internet] Accesible en: https://www.nccn.org/patients/guidelines/content/PDF/myeloma-esl-patient.pdf [Último acceso] 28 abril 2025.
- Fundación Josep Carreras contra la leucemia. Guía práctica sober mieloma múltiple para pacientes y cuidadores. 2024. [Internet] Disponible en https://fcarreras.org/wp-content/uploads/2024/03/Manual-MM-Cuidador_MARZO_v2-1.pdf [çUltimo acceso] 15 abril 2025.
- Das N, Dahiya M, Gupta R, et al. Flow cytometric immunophenotyping of plasma cells across the spectrum of plasma cell proliferative disorders: A fresh insight with pattern-based recognition. Cytometry B Clin Cytom. 2022;102(4):292-302..
- Rincón-Vásquez N, Jaramillo-Arbeláez P, Llanos-Albornoz C. Morfología e inmunofenotipo de las células plasmáticas en el mieloma múltiple Medicina & Laboratorio [Internet]. 2017;23(9-10):443-58.
- Cho SF, Anderson KC, Tai YT. Targeting B Cell Maturation Antigen (BCMA) in Multiple Myeloma: Potential Uses of BCMA-Based Immunotherapy. Front Immunol. 2018;9:1821.
- Plummer C, Driessen C, Szabo Z, et al. Management of cardiovascular risk in patients with multiple myeloma. Blood Cancer J. 2019;9(3):26.
- Ramos AL, Trindade M, Santos Pinto A, et al. Pleural effusion and multiple myeloma - more than meets the eye: A case report. Mol Clin Oncol. 2021;15(5):238.
- Raje NS, Anaissie E, Kumar SK, et al. Consensus guidelines and recommendations for infection prevention in multiple myeloma: a report from the International Myeloma Working Group. Lancet Haematol. 2022;9(2):e143-e61.
UA Junio 2025: NP-ES-MMU-WCNT-250003(v1)
