Mielofibrosis
Diagnóstico de la mielofibrosis
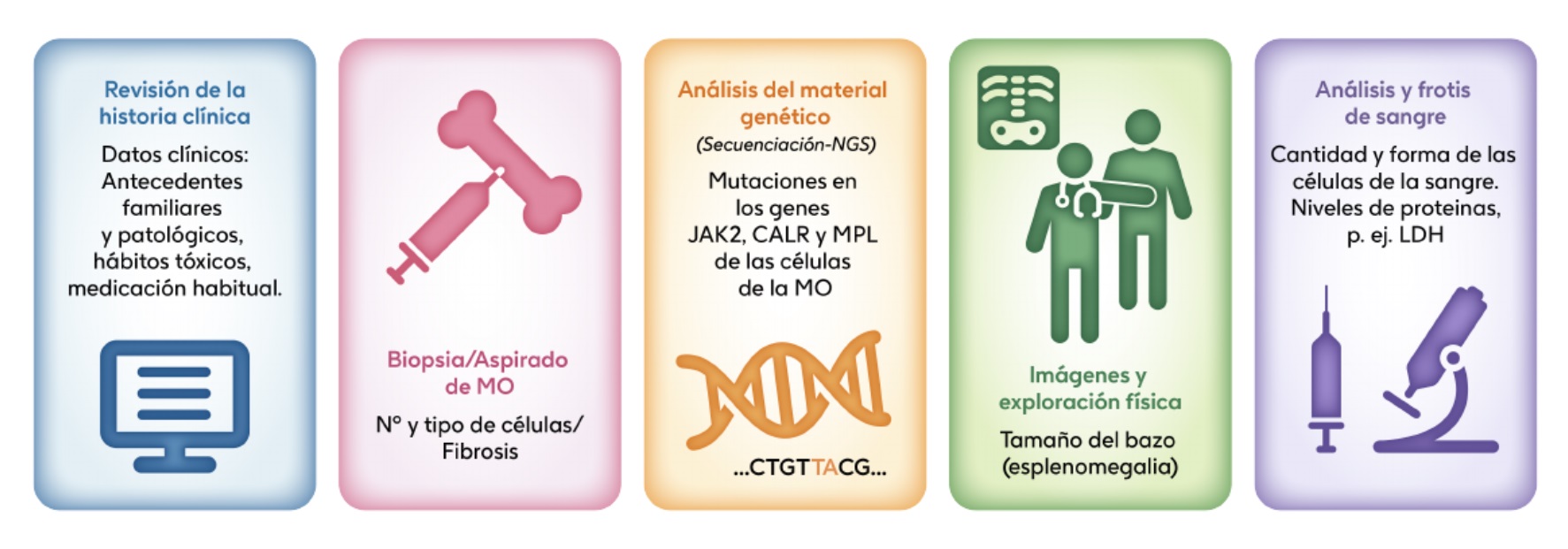
El diagnóstico de mielofibrosis (primaria y secundaria) se determina analizando diferentes parámetros establecidos y publicados por especialistas expertos en la enfermedad [1-3]. Esto permite diferenciar la mielofibrosis de cualquier otra enfermedad (cáncer) de la sangre que pudiera parecerse.
LDH: lactato deshidrogenasa, MO: médula ósea; NGS: Next-generatiion sequencing
Pronóstico/evolución de la mielofibrosis
Tras la evaluación inicial, con toda la información obtenida de las diferentes pruebas y evaluaciones [8-11], se realiza una estimación de cómo puede evolucionar la mielofibrosis. Este proceso, que se conoce como “estratificación del riesgo”, se realiza al principio (al diagnóstico) y durante el trascurso de la enfermedad [5].
Para calcular el pronóstico de la mielofibrosis se usan herramientas que asignan valores a alguna de las variables analizadas (edad, características clínicas y genéticas, valores de los análisis, síntomas [calidad de vida]...). La cifra que resulta al sumar todos los valores es la que determina el riesgo [5]. Establecer el riesgo ayuda a los médicos a decidir las medidas y el tratamiento idóneo para el manejo de la mielofibrosis de cada paciente [12].
Se ha relacionado la presencia de las siguientes características con un peor pronóstico de la mielofibrosis [5]:
- Más de 65 años de edad.
- Síntomas constitucionales.
- Anemia (niveles de hemoglobina <10 g/dl).
- Presencia en sangre de una cantidad de células sanguíneas defectuosas/inmaduras, denominadas blastos, mayor al 1% del total de las células sanguíneas analizadas.
- Alteraciones determinadas en el material genético.
- Niveles bajos de plaquetas.
- Necesidad de transfusiones.
- Fibrosis en la médula ósea.
Durante el trascurso de la enfermedad, los médicos utilizan diferentes herramientas para evaluar y cuantificar los síntomas para así vigilar la mielofibrosis (evolución, respuesta al tratamiento...).[13]
Complicaciones de la mielofibrosis
A lo largo de su enfermedad, los pacientes con mielofibrosis pueden sufrir algunas complicaciones que se describen a continuación. La detección de forma temprana de las mismas puede ayudar a evitar que la mielofibrosis empeore.
- Infecciones. En los pacientes con mielofibrosis es mayor el riesgo de sufrir infecciones [19] por bacterias (p.ej. Estreptoco y Escherichia coli), virus (p.ej. Herpes zoster) [24] y hongos [25]. Las causas que hacen que el riesgo aumente incluyen [25, 26]:
- Las sustancias que liberan las células tumorales que alteran el sistema inmune.
- La diminución de un tipo de glóbulos blancos (los linfocitos B).
- Algunos efectos secundarios de determinados medicamentos utilizados para el tratamiento de la mielofibrosis u otras enfermedades.
- Tener que recibir transfusiones de sangre.
- Las hospitalizaciones.
- El aumento de la fragilidad de los pacientes.
- Sangrados. La presencia de un número reducido de plaquetas (trombocitopenia) puede suponer un riesgo de sangrados [16]. Aunque no son frecuentes, pueden aparecer sangrados graves (en el 5.3% de los pacientes). Se asocian con el uso de anticoagulantes y tener un alto riesgo de progresión [17].
- Evolución a leucemia. Si se acumulan nuevas alteraciones en el material genético de los pacientes con mielofibroris (mutaciones puntuales, repeticiones o modificaciones) podría verse afectada la función y la producción de determinadas proteínas. Esto podría provocar la evolución de la mielofibrosis a otro tipo de cáncer de la sangre, la leucemia mieloide aguda (LMA) [14]. Esta evolución se ha observado en el 14% de los casos de mielofibrosis primaria [15].
- Enfermedades cardiovasculares. Pueden aparecer, aunque en pocas ocasiones (aproximadamente en el 2% de los pacientes con mielofibrosis primaria y secundaria, por año) [12, 18].
- Aumento de la presión de la sangre en: las arterias de los pulmones (hipertensión pulmonar) [5, 19] o en la vena porta del hígado (hipertensión portal) [5, 19].
- Formación de trombos en las venas (tromboembolismo venoso) [19-21]. Para el manejo de los trombos, pueden utilizarse fármacos anticoagulantes [22].
- Obstrucción del flujo sanguíneo en el bazo que puede provocar que deje de funcionar parte del mismo (infarto esplénico) [21, 23].
- Sobrecarga (acúmulo) de hierro en sangre. Es una consecuencia de las transfusiones de sangre que, en caso de producirse, puede conllevar infecciones y complicaciones endocrinas, hepáticas o cardiacas a largo plazo [12].
Desde GSK Oncohematología tenemos el compromiso de Transformar juntos el cáncer en Esperanza. Esto significa apoyar el conocimiento y prevención de la enfermedad, trabajando por una investigación, desarrollo e innovación continua, que ayude a cambiar la calidad de vida de los pacientes.
Referencias
- Arber DA, Orazi A, Hasserjian RP, et al. International Consensus Classification of Myeloid Neoplasms and Acute Leukemias: integrating morphologic, clinical, and genomic data. Blood. 2022;140(11):1200-28.
- Khoury JD, Solary E, Abla O, et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic/Dendritic Neoplasms. Leukemia. 2022;36(7):1703-19.
- Gianelli U, Thiele J, Orazi A, et al. International Consensus Classification of myeloid and lymphoid neoplasms: myeloproliferative neoplasms. Virchows Arch. 2023;482(1):53-68.
- Garmezy B, Schaefer JK, Mercer J, et al. A provider's guide to primary myelofibrosis: pathophysiology, diagnosis, and management. Blood Rev. 2021;45:100691.
- Tefferi A. Primary myelofibrosis: 2023 update on diagnosis, risk-stratification, and management. Am J Hematol. 2023;98(5):801-21.
- Montes-Moreno S, Acevedo A, Besses C, et al. Evaluación sistemática de la biopsia de médula ósea en casos de sospecha de mielofibrosis primaria. Propuesta de informe diagnóstico estandarizado. Consenso de expertos de las SEAP/SEHH. Rev Esp Patol. 2014;47(4):210-7.
- Amé S, Barraco F, Ianotto JC, et al. Advances in management of primary myelofibrosis and polycythaemia vera: Implications in clinical practice. EJHaem. 2023;4(3):779-91.
- Guglielmelli P, Lasho TL, Rotunno G, et al. MIPSS70: Mutation-Enhanced International Prognostic Score System for Transplantation-Age Patients With Primary Myelofibrosis. J Clin Oncol. 2018;36(4):310-8.
- Tefferi A, Guglielmelli P, Lasho TL, et al. MIPSS70+ Version 2.0: Mutation and Karyotype-Enhanced International Prognostic Scoring System for Primary Myelofibrosis. J Clin Oncol. 2018;36(17):1769-70.
- Gangat N, Caramazza D, Vaidya R, et al. DIPSS plus: a refined Dynamic International Prognostic Scoring System for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count, and transfusion status. J Clin Oncol. 2011;29(4):392-7.
- Kosiorek HE, Scherber RM, Geyer HL, et al. Quality of life independently predicts overall survival in myelofibrosis: Key insights from the COntrolled MyeloFibrosis Study with ORal Janus kinase inhibitor Treatment (COMFORT)-I study. Br J Haematol. 2022;198(6):1065-8.
- Passamonti F, Mora B. Myelofibrosis. Blood. 2023;141(16):1954-70.
- Yoon J, Pettit K. Improving symptom burden and quality of life in patients with myelofibrosis: current strategies and future directions. Expert Rev Hematol. 2021;14(7):607-19.
- Dunbar AJ, Rampal RK, Levine R. Leukemia secondary to myeloproliferative neoplasms. Blood. 2020;136(1):61-70.
- Rontauroli S, Carretta C, Parenti S, et al. Novel Molecular Insights into Leukemic Evolution of Myeloproliferative Neoplasms: A Single Cell Perspective. Int J Mol Sci. 23(23):15256
- Tremblay D, Baine I, Mascarenhas J. Thrombocytopenia in Patients With Myelofibrosis: A Practical Management Guide. Clin Lymphoma Myeloma Leuk. 2022;22(12):e1067-e74.
- Hernández-Boluda JC, Pastor-Galán I, Arellano-Rodrigo E, et al. Predictors of thrombosis and bleeding in 1613 myelofibrosis patients from the Spanish Registry of Myelofibrosis. Br J Haematol. 2022;199(4):529-38
- Barbui T, Carobbio A, Cervantes F, et al. Thrombosis in primary myelofibrosis: incidence and risk factors. Blood. 2010;115(4):778-82.
- Mughal TI, Vaddi K, Sarlis NJ, et al. Myelofibrosis-associated complications: pathogenesis, clinical manifestations, and effects on outcomes. Int J Gen Med. 2014;7:89-101.
- Saliba W, Mishchenko E, Cohen S, et al. Association between myelofibrosis and thromboembolism: A population-based retrospective cohort study. J Thromb Haemost. 2020;18(4):916-25.
- Tefferi A, Gangat N, Pardanani A, Crispino JD. Myelofibrosis: Genetic Characteristics and the Emerging Therapeutic Landscape. Cancer Res. 2022;82(5):749-63.
- Kelliher S, Falanga A. Thrombosis in myeloproliferative neoplasms: A clinical and pathophysiological perspective. Thrombosis Update. 2021;5:100081.
- Tefferi A. Myelofibrosis with myeloid metaplasia. N Engl J Med. 2000;342(17):1255-65.
- Te Linde E, Boots LJE, Daenen LGM, et al. High Incidence of Herpes Zoster in Patients Using Ruxolitinib for Myeloproliferative Neoplasms: Need for Prophylaxis. Hemasphere. 2022;6(11):e793.
- Landtblom AR, Andersson TM, Dickman PW, et al. Risk of infections in patients with myeloproliferative neoplasms-a population-based cohort study of 8363 patients. Leukemia. 2021;35(2):476-84.
- Caocci G, Simula MP, Ghiani S, et al. Increased incidence of infection in patients with myelofibrosis and transfusion-associated iron overload in the clinical setting. Int J Hematol. 2020;111(5):614-8.
UA Marzo 2024: NP-ES-MML-PINS-230005(v1)
